Đề thi Trung học Phổ thông Quốc gia năm 2018 môn Hóa học - Trường THPT Chuyên Lương Văn Chánh (Có đáp án)
Bạn đang xem tài liệu "Đề thi Trung học Phổ thông Quốc gia năm 2018 môn Hóa học - Trường THPT Chuyên Lương Văn Chánh (Có đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề thi Trung học Phổ thông Quốc gia năm 2018 môn Hóa học - Trường THPT Chuyên Lương Văn Chánh (Có đáp án)
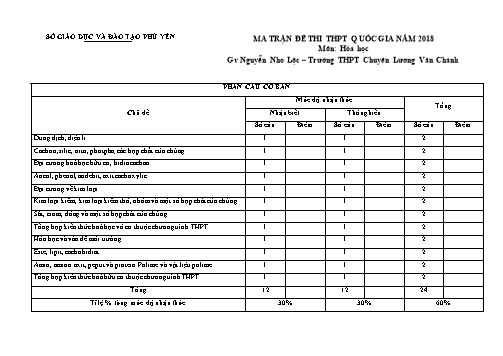
SỞ GIÁO DỤC VÀ ĐÀO TẠO PHÚ YÊN MA TRẬN ĐỀ THI THPT QUỐC GIA NĂM 2018 Môn: Hóa học Gv Nguyễn Nho Lộc – Trường THPT Chuyên Lương Văn Chánh PHẦN CÂU CƠ BẢN Mức độ nhận thức Tổng Chủ đề Nhận biết Thông hiểu Số câu Điểm Số câu Điểm Số câu Điểm Dung dịch, điện li 1 1 2 Cacbon, silic, nitơ, photpho; các hợp chất của chúng 1 1 2 Đại cương hoá học hữu cơ, hiđrocacbon 1 1 2 Ancol, phenol, anđehit, axit cacboxylic 1 1 2 Đại cương về kim loại 1 1 2 Kim loại kiềm, kim loại kiềm thổ, nhôm và một số hợp chất của chúng. 1 1 2 Sắt, crom, đồng và một số hợp chất của chúng. 1 1 2 Tổng hợp kiến thức hoá học vô cơ thuộc chương trình THPT 1 1 2 Hóa học và vấn đề môi trường 1 1 2 Este, lipit, cacbohiđrat 1 1 2 Amin, amino axit, peptit và protein. Polime và vật liệu polime 1 1 2 Tổng hợp kiến thức hoá hữu cơ thuộc chương trình THPT 1 1 2 Tổng 12 12 24 Tỉ lệ % từng mức độ nhận thức 30% 30% 60% + - 2- 2+ + - 2+ - A. Na , Cl , S , Cu . B. K , OH , Ba , HCO3 . + 2+ - - - + + - C. Ag , Ba , NO3 , OH . D. HSO4 , NH4 , Na , NO3 . Câu 14: Có nhiều nguyên nhân gây ra căn bệnh đau dạ dày, trong đó nguyên nhân phổ biến là dư axit trong dạ dày. Để làm giảm nồng độ axit trong dạ dày, người ta thường dùng thuốc chứa chất nào sau đây A. NaCl.B. CaCO 3. C. NaHCO3. D. HCl. Câu 15: Cho hình vẽ mô tả quá trình định tính các nguyên tố trong hợp chất hữu cơ. Hãy cho biết vai trò của CuSO4 (khan) và biến đổi của nó trong thí nghiệm. Bông và CuSO4(khan) Hợp chất hữu cơ dung dịch Ca(OH)2 A. Định tính nguyên tố C và màu CuSO 4 từ màu trắng sang màu xanh. B. Định tính nguyên tố H và màu CuSO 4 từ màu trắng sang màu xanh. C. Định tính nguyên tố O và màu CuSO 4 từ màu trắng sang màu xanh. D. Định tính nguyên tố H và màu CuSO 4 từ màu xanh sang màu trắng. Câu 16: Thuốc thử duy nhất có thể dùng để phân biệt ba chất lỏng: phenol, stiren và ancol benzylic là: A. Na. B. Dung dịch NaOH. C. Dung dịch Br2. D. Quỳ tím. Câu 17. Khi điện phân dung dịch Cu(NO3)2 thì tại anot xảy ra: 2+ A. Sự khử các phân tử H2O B. Sự oxi hóa các ion Cu 2+ C. Sự oxi hóa các phân tử H2O D. Sự khử các ion Cu Câu 18: Nguyên tắc làm mềm nước cứng là: 2- 2+ 2+ A. Loại bỏ ion SO4 trong nước. B. Làm giảm ion Ca và ion Mg trong nước. 2+ 2+ - C. Khử ion Ca và ion Mg trong nước. D. làm giảm ion HCO3 trong nước. Câu 19: Đồng kim loại không tan được trong A. dung dịch HCl có mặt O2. B. dung dịch H2SO4 (loãng, nóng). C. dung dịch Fe2(SO4)3. D. dung dịch hỗn hợp NaNO3 và H2SO4. Câu 20: Một số vùng đất canh tác thường bị chua cây trồng khó phát triển do không thể thích ứng với môi trường có pH thấp. Để khử chua người ta thường dùng chất nào sau đây A. phân lân. B. đá vôi. C. phân đạm. D. vôi tôi. Câu 21: Những người sống ở gần các lò gạch, lò vôi hay là các trường hợp đốt than trong phòng kín, thường bị đau đầu, buồn nôn, hô hấp khó và có thể dẫn đến tử vong, hiện tượng này gọi là ngộ độc khí than. Nếu trong phòng kín khi ngộ độc khí than thì phải nhanh chóng mở thông thoáng tất cả các cánh cửa cho không khí lưu thông. Chất nên hiện tượng ngộ độc khí than là A. CO B. CH4 C. H2O D. CO2 Câu 22: Este A điều chế từ ancol metylic có tỉ khối so với oxi là 2,3125. Công thức của A là A. C2H5COOCH3. B. CH3COOCH3. C. CH3COOC2H5. D. C2H5COOC2H5. Câu 23: Sắp xếp các hợp chất sau: (1) metyl amin; (2) đimetyl amin; (3) benzyl amin; (4) anilin theo trình tự tính bazơ giảm dần A. (1) > (4) > (2) > (3) B. (1) > (2) > (3) > (4) C. (2) > (1) > (4) > (3) D. (2) > (1) > (3) > (4) Câu 24: Cho sơ đồ chuyển hoá: Glucozơ X Y Cao su Buna. Hai chất X, Y lần lượt là A. CH3CH2OH và CH3CHO. B. CH3CH2OH và CH2=CH2. C. CH2CH2OH và CH3-CH=CH-CH3. D. CH3CH2OH và CH2=CH-CH=CH2. MỨC ĐỘ VẬN DỤNG (12 CÂU: CÂU 25 ĐẾN CÂU 36) Câu 25: Cho 100ml dung dịch chứa NaOH 0,1M và Ba(OH)2 0,2M tác dụng hoàn toàn với 100 ml dung dịch H3PO4 0,3M. Dung dịch thu được gồm: A. Muối photphat và muối đihiđrophotphat. B. Chỉ chứa muối photphat. C. Tinh bột, glucozơ và khí cacbonic D. Tinh bột, glucozơ và ancol etylic Câu 34: Hai hợp chất hữu cơ mạch hở có công thức phân tử lần lượt là C2H8O3N2 và C3H7O2N đều tác dụng với dung dịch NaOH đun nóng, cho hai amin đơn chức bậc 1 thoát ra. Nhận xét nào sau đây đúng về hai hợp chất hữu cơ trên? A. Chúng đều tác dụng với dung dịch brom B. Chúng đều là chất lưỡng tính C. Phân tử của chúng đều có liên kết ion D. Chúng đều tác dụng với H2 (xúc tác Ni, đun nóng) Câu 35: Cho 15,2 gam chất hữu cơ X phản ứng vừa đủ với 300 ml dung dịch NaOH 1M thu được dung dịch Y. Cô cạn dung dịch Y chỉ thu được hơi nước và 23,6 gam hỗn hợp muối khan Z. Đốt cháy hoàn toàn Z thu được Na2CO3, 14,56 lít CO2 (đkc) và 6,3 gam H2O (biết X có công thức phân tử trùng với công thức đơn giản nhất). Công thức phân tử của X là A. C8H10O3. B. C8H8O3. C. C8H8O. D. C9H8O2. Câu 36: Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: HCOOH; CH3COOH; HCl; C6H5OH. Giá trị pH của các dung dịch trên cùng nồng độ 0,01M, ở 250C đo được như sau: Chất X Y Z T pH 6,48 3,22 2,00 3,45 Nhận xét nào sau đây đúng? A. Z có phản ứng với kim loại Cu B. X được điều chế trực tiếp từ ancol etylic. C. T tạo kết tủa trắng với nước brom. D. Y có phản ứng tráng bạc. MỨC ĐỘ VẬN DỤNG CAO (04 CÂU: CÂU 37 ĐẾN CÂU 40) Câu 37. Cho 31,15 gam hỗn hợp bột Zn và Mg (tỷ lệ mol 1 : 1) tan hết trong dung dịch hỗn hợp gồm NaNO3 và NaHSO4 thu được dung dịch X chỉ chứa m gam hỗn hợp các muối và 4,48 lít (đktc) hỗn hợp khí Y gồm N2O và H2. Khí Y có tỷ khối so vơi H2 bằng 11,5. Giá trị của m gần nhất với A. 239. B. 240. C. 241. D. 242. Câu 38. Trộn 10,17 gam hỗn hợp X gồm Fe(NO3)2 và Al với 4,64 gam FeCO3 được hỗn hợp Y. Cho Y vào lượng vừa đủ dd chứa 0,56 mol KHSO4 được dd Z chứa 83,41 gam muối sunfat trung hòa và m gam hỗn hợp khí T trong đó có chứa 0,01 mol H2. Thêm NaOH vào Z đến khi toàn bộ muối sắt chuyển hết thành hidroxit và ngừng khí thoát ra thì cần 0,57 mol NaOH, lọc kết tủa nung trong không khí đên khối lượng không đổi thu được 11,5 gam chất rắn. Giá trị của m là A. 2,52 B. 2,7 C. 3,42 D. 3,22 Câu 39. X là hỗn hợp gồm HOOC-COOH, OHC-COOH, OHC-C≡C-CHO, OHC-C≡C-COOH; Y là axit cacboxylic no, đơn chức, mạch hở. Đun nóng m gam X với lượng dư dung dịch AgNO3 trong NH3, thu được 23,76 gam Ag. Nếu cho m gam X tác dụng với NaHCO3 dư thì thu được 0,07 mol CO2. Đốt cháy hoàn toàn hỗn hợp gồm m gam X và m gam Y cần 0,805 mol O2, thu được 0,785 mol CO2. Giá trị của m là A. 8,8. B. 4,6. C. 6,0. D. 7,4. Câu 40. Thủy phân m gam hỗn hợp X gồm một tetrapeptit A và một pentapeptit B (A và B chứa đồng thời glyxin và alanin trong phân tử) bằng một lượng dung dịch NaOH vừa đủ rồi cô cạn thu được (m + 15,8) gam hỗn hợp muối. Đốt cháy toàn bộ lượng muối sinh ra bằng một lượng oxi vừa đủ thu được Na2CO3 và hỗn hợp hơi Y gồm CO2, H2O và N2. Dẫn toàn bộ hỗn hợp hơi Y đi rất chậm qua bình đựng dung dịch NaOH đặc dư thấy khối lượng bình tăng thêm 56,04 gam so với ban đầu và có 4,928 lít một khí duy nhất (đktc) thoát ra khỏi bình. Xem như N2 không bị nước hấp thụ, các phản ứng xảy ra hoàn toàn. Thành phần phần trăm khối lượng của A trong hỗn hợp X gần nhất với A. 53,1%. B. 55,9%. C. 30,9%. D. 35,4%. --- HẾT --- Bảo toàn nguyên tố H → nH2O = = 0,23 mol Bảo toàn khối lượng → m = 10,17 + 4,64 + 0,56. 136-83,41-0,23. 18 = 3.42 gam. Câu 39. X là hỗn hợp gồm HOOC-COOH, OHC-COOH, OHC-C≡C-CHO, OHC-C≡C-COOH; Y là axit cacboxylic no, đơn chức, mạch hở. Đun nóng m gam X với lượng dư dung dịch AgNO3 trong NH3, thu được 23,76 gam Ag. Nếu cho m gam X tác dụng với NaHCO3 dư thì thu được 0,07 mol CO2. Đốt cháy hoàn toàn hỗn hợp gồm m gam X và m gam Y cần 0,805 mol O2, thu được 0,785 mol CO2. Giá trị của m là A. 8,8. B. 4,6. C. 6,0. D. 7,4. Câu 39: A Cho X tác dụng với AgNO3/NH3 thì nCHO = 0,2nAg =0,11 mol Cho X tác dụng với NaHCO3 dư thì nCOOH = nCO2 =0,07 mol CO2 Quy hỗn hợp X về và Y là CnH2nỞ2 Có nH2O do X sinh ra = 0,5 (nCHO + nCOOH ) = 0,09 mol Gọi số mol H2Ở đó Y sinh ra là y mol → sô mol CO2 đó Y sinh ra y mol ( do Y là axit no đơn chức Ta có hệ → → m = 0,11. 29 + 0,07. 45 + 0,205.12 = 8,8 gam Câu 40. Thủy phân m gam hỗn hợp X gồm một tetrapeptit A và một pentapeptit B (A và B chứa đồng thời glyxin và alanin trong phân tử) bằng một lượng dung dịch NaOH vừa đủ rồi cô cạn thu được (m + 15,8) gam hỗn hợp muối. Đốt cháy toàn bộ lượng muối sinh ra bằng một lượng oxi vừa đủ thu được Na2CO3 và hỗn hợp hơi Y gồm CO2, H2O và N2. Dẫn toàn bộ hỗn hợp hơi Y đi rất chậm qua bình đựng dung dịch NaOH đặc dư thấy khối lượng bình tăng thêm 56,04 gam so với ban đầu và có 4,928 lít một khí duy nhất (đktc) thoát ra khỏi bình. Xem như N2 không bị nước hấp thụ, các phản ứng xảy ra hoàn toàn. Thành phần phần trăm khối lượng của A trong hỗn hợp X gần nhất với A. 53,1%. B. 55,9%. C. 30,9%. D. 35,4%. Câu 40: A Gọi số mol của A (CnH2n-2N4O5 với 8 ≤ n ≤ 12) và B (CmH2m-3N5O6 với 10 ≤ m ≤15 )lần lượt là x, y Bảo toàn khối lượng trong phản ứng thủy phân → m + 40. ( 4x + 5y) = m + 15,8 + 18 ( x+ y) Bảo toàn nguyên tố N → 4x + 5y = 2. ( 4,928 : 22, 4) = 0,44 Giải hệ → x = 0,06 và y = 0,04 Hỗn hợp peptit được cấu tạo bởi các aminoaxit no chứa 1 nhóm NH2, 1 nhóm COOH → muối hình thành trong quá trình thủy phân có công thức CaH2aNO2Na : 0,44 mol . Gọi số mol CO2 và H2O lần lượt là a, b Khi đó có hệ → Bảo toàn nguyên tố C → ∑ nC = nNa2CO3 + nCO2 = 0,22 + 0,84 = 1,06 mol Ta có 0,06n + 0,04m = 1,06 → 3n+ 2m = 53
File đính kèm:
 de_thi_trung_hoc_pho_thong_quoc_gia_nam_2018_mon_hoa_hoc_tru.doc
de_thi_trung_hoc_pho_thong_quoc_gia_nam_2018_mon_hoa_hoc_tru.doc

