Đề thi tốt nghiệp THPT Quốc gia năm 2018 môn Hóa học - Trường THPT Nguyễn Huệ (Có đáp án)
Bạn đang xem tài liệu "Đề thi tốt nghiệp THPT Quốc gia năm 2018 môn Hóa học - Trường THPT Nguyễn Huệ (Có đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề thi tốt nghiệp THPT Quốc gia năm 2018 môn Hóa học - Trường THPT Nguyễn Huệ (Có đáp án)
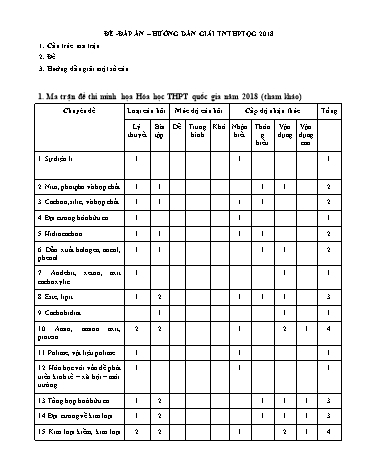
ĐỀ -ĐÁP ÁN – HƯỚNG DẪN GIẢI TNTHPTQG 2018 1. Cấu trúc ma trận 2. Đề 3. Hướng dẫn giải một số câu 1. Ma trận đề thi minh họa Hóa học THPT quốc gia năm 2018 (tham khảo) Chuyên đề Loại câu hỏi Mức độ câu hỏi Cấp độ nhận thức Tổng Lý Bài Dễ Trung Khó Nhận Thôn Vận Vận thuyết tập bình biết g dụng dụng hiểu cao 1. Sự điện li 1 1 1 2. Nitơ, photpho và hợp chất 1 1 1 1 2 3. Cacbon, silic, và hợp chất 1 1 1 1 2 4. Đại cương hóa hữu cơ 1 1 1 5. Hiđrocacbon 1 1 1 1 2 6. Dẫn xuất halogen, ancol, 1 1 1 1 2 phenol 7. Anđehit, xeton, axit 1 1 1 cacboxylic 8. Este, lipit 1 2 1 1 1 3 9. Cacbohidrat 1 1 1 10. Amin, amino axit, 2 2 1 2 1 4 protein 11. Polime, vật liệu polime 1 1 1 12. Hóa học với vấn đề phát 1 1 1 triển kinh tế – xã hội – môi trường 13. Tổng hợp hoá hữu cơ 1 2 1 1 1 3 14. Đại cương về kim loại 1 2 1 1 1 3 15. Kim loại kiềm, kim loại 2 2 1 2 1 4 TRƯỜNG THPT NGUYỄN HUỆ KÌ THI TNTHPT QUỐC GIA NĂM 2018 TỔ HÓA HỌC Môn: KHOA HỌC TỰ NHIÊN – HÓA HỌC * Thời gian làm bài: 50 phút, không kể thời gian phát đề ĐỀ MINH HỌA (Đề thi có 40 câu / 4 trang) Cho biết nguyên tử khối của các nguyên tố : H =1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S =32; Cl = 35,5; K = 39; Ca = 40; Cr = 52; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba=137. Câu 41: (B) Trường hơp nào sau đây dẫn điện được: A. Nước cất. B. NaOH rắn khan. C. Khí hiđroclorua. D. Nước biển. Câu 42: (B)Dẫn luồng khí CO nóng dư đi qua ống sứ chứa Al2O3,CuO phản ứng hoàn toàn .Chất rắn còn lại trong ống gồm: A. Al,Cu. B. Al,CuO. C. Al2O3,Cu. D. Cu,C. Câu 43 (B): Trong thành phần phân tử chất hữu cơ nhất thiết phải có A. nguyên tố cacbon và hiđro.B. nguyên tố cacbon. C. nguyên tố cacbon, hiđro và oxi.D. nguyên tố cacbon và nitơ. Câu 44:(B) PVC là sản phẩm trùng hợp của : A. CH2= CH2 B. CH2= CH- CH= CH2 C. CH2= CHCl D. CH2= C = CH2 Câu 45:(B) Xà phòng hóa HCOOCH3 trong dung dịch NaOH đun nóng, thu được muối có công thức là A. HCOONa B. CH3COOH C. CH3COONa D. HCOOH Câu 46:(B) Công thức phân tử của alanin là: A. C6H5NH2 B. H2NCH(CH3)COOH C. H2NCH2COOH D.C2H5NH2 Câu 47: (B) Tơ nào sau đây thuộc loại tơ nhân tạo: A. Tơ nitron B. Tờ tằm C.Tơ nilon-6,6 D.tơ visco Câu 48: (B) Nước thải công nghiệp thường chứa các ion kim loại nặng như Hg 2+, Pb2+, Fe3+... Để xử lí sơ bộ nước thải trên, làm giảm nồng độ các ion kim loại nặng với chi phí thấp, người ta sử dụng chất nào sau đây ? A. Ca(OH)2. B. NaCl. C. HCl. D. KOH. Câu 49: (B) Quặng Boxit có thành phần chính là ? A.FeS2 B.Al 2O3 C.Fe3O4 D.Na3AlF6 Câu 50: (B) Kim loại Fe không phản ứng với dung dịch: A. H2SO4 đặc nguội B. CuSO4 loãng C. HNO3 đặc, nguội D.FeCl3 loãng Câu 51: (B) Dung dịch nào sau đây tác dụng được với Cu ? A. HNO3 loãng B. H3PO4 loãng C. HCl loãng D. H2SO4 loãng Câu 52: (H) Cho các phản ứng sau: Pt, đun nóng (1) Cu(NO3)2 → (2) NH4NO2 →→ (3) NH3 + O2 → (4) NH3 + Cl2 →→ (5) NH4Cl → (6) NH3 + CuO → Các phản ứng tạo ra khí N2 là: A. 2,4,6. B. 3,5,6. C. 1,3,4. D. 1,2,5. Câu 53: (H) Cho 10,6g Na2CO3 tác dụng hoàn toàn với dung dịch HCl dư thu được V lít khí CO 2(đktc). Giá trị V là? A. 4,48 lítB. 5,6 lít C. 2,24 lítD. 3,36 lít Câu 68: (VD) Cho các phản ứng : to (A) + dd NaOH (B) + (C) ; to (B) + dd NaOHrắn (D)+ (E) ; 1500o C (D) (F) + H2; xóc t¸c ( F) + H2O (C) Các chất (A) và (C) là: A. HCOOCH=CH2 và HCHO C. CH 3COOCH = CH2 và HCHO B. CH3COOCH = CH2 và CH3CHO D. CH 3COOC2H5 và CH3CHO Câu 69:(VD) Cho 7,56 lít hỗn hợp X (ở đktc) gồm C 2H2 và H2 qua Ni đun nóng, thu được hỗn hợp khí Y chỉ gồm 3 hiđrocacbon, tỷ khối của Y so với H 2 bằng 14,25. Cho Y phản ứng hoàn toàn với dung dịch Br2 dư. Khối lượng (gam)của Br2 đã tham gia phản ứng là : A. 24,0 .B. 18,0 . C. 20,0 .D. 18,4 . .Câu 70: (VD)Cho m gam hỗn hợp X gồm Na, Ca tan hết vào dung dịch Y chứa 0,08 mol NaHCO 3 và 0,04 mol CaCl2, sau phản ứng thu được 7 gam kết tủa và thấy thoát ra 0,896 lít khí (đktc). Giá trị của m là A. 1,72B. 1,56C. 1,66D. 1,43 Câu 71: (VD) Dẫn hơi C2H5OH qua ống đựng CuO nung nóng được 11,76 gam hỗn hợp X gồm anđehit, ancol dư và nước. Cho X tác dụng với Na dư được 2,24 lít H2 (ở đktc). % ancol bị oxi hoá là A. 80%.B. 75%.C. 60%. D. 50%. Câu 72: (VD)Sục 13,44 lít CO2 (đktc) vào 200 ml dung dịch X gồm Ba(OH) 2 1,5M và NaOH 1M. Sau phản ứng thu được dung dịch Y. Cho dung dịch Y tác dụng với 200 ml dung dịch hỗn hợp BaCl 2 1,2M và KOH 1,5M thu được m gam kết tủa. Giá trị của m là: A. 66,0 B. 39,4 C. 47,3 D. 59,1 Câu 73: (VD)X, Y, Z, T, P là các dung dịch chứa các chất sau axit glutamic, alanin, phenylamoni clorua, lysin và amoni clorua. Thực hiện các thí nghiệm và có kết quả ghi theo bảng sau X Y Z T P Quỳ tím Hóa đỏ Hóa xanh Không đổi Hóa đỏ Hóa đỏ màu Dung dịch Khí thoát ra Dung dịch Dung dịch Dung dịch Dung dịch NaOH đun nóng trong suốt trong suốt phân lớp trong suốt Các chất X, Y, Z, T, P lần lượt là. A. amoni clorua, phenylamoni clorua, alanin, lysin, axit glutamic. B. axit glutamic, lysin, alanin, amoni clorua, phenyl amoniclorua. C. amoni clorua, lysin, alanin, phenylamoni clorua, axit glutamic. D. axit glutamic, amoni clorua, phenylamoni clorua, lysin, alanin. Câu 74: (VD) Hỗn hợp X gồm Fe 2O3, FeO và Cu (trong đó sắt chiếm 52,5% về khối lượng). Cho m gam X tác dụng với 420 ml dung dịch HCl 2M dư, thu được dung dịch Y và còn lại 0,2 m gam chất rắn không tan. Cho dung dịch AgNO3 dư vào Y thu được khí NO và 141,6 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là: A. 20 B. 32 C. 36 D. 24 Câu 69 :Hướng dẫn : Theo giả thiết và áp dụng bảo toàn nguyên tố H, bảo toàn số liên kết , ta có : MY (C H ) 14,25.2 28,5 2 y 7,56 y.nC H nH 2n(C H , H ) 2. 0,675 2 y 2 2 2 22,4 y 4,5; n 2.2 4,5 2 0,15 C H (k 0,75) 2 y 2 nBr 0,75.nC H 0,1125 mol 18 gam 2 2 y Câu 73: Chọn B. a mol Cu(d) :0,2 m (g) b mol HCl(d) 2 2 AgNO - Quá trình: Fe2O3 , FeO ,Cu Fe ,Cu ,Cl , H 3 Ag, AgCl NO (d) c mol m (g) dung dÞch Y 141,6(g) BT:Cl m 143,5nAgCl - Xét hỗn hợp kết tủa ta có : nAgCl nHCl 0,84 mol nAg 0,195mol 108 - Khi cho X tác dụng với HCl và dung dịch Y tác dụng với AgNO 3 thì ta có hệ sau : 160nFe O 72nFeO 64nCu(p) m mr¾n 2 3 160a 72b 64a 0,8m a 0,05 Theo ®Ò ta cã mFe 56.2a 56b 0,525 0,525 b 0,2 mX m c 0,035 BT:e n 2n 3n n b 2a 3c 0,195 FeO Cu(p) NO Ag m 32 6a 2b 4c 0,84 nHCl 6nFe2O3 2nFeO 4nNO Câu 76: ta có 0,288a = 3y + 0,06 (1) Nhìn vào đồ thị ta có thể tính nhanh các giá trị OH- tại kết tủa cực đại 0,51mol và tan hết kết tủa là 0,66 mol Xét tam giác đồng dạng ta có : (0,66 – 0,448a)/0,15 = y/0,15 (2) → a= 0,125 Câu 78: Qui đổi COONa a mol BT.C: 0,5a+c =0,425 a= 0,25 Muối NH2 b mol BT.O: 0,5b+c =0,4 b = 0,2 CH2 c mol 68a+ 15b + 14c =24,2 c= 0,3 H (a-b) mol → CnH2n + 1 COONa = nH = a-b = 0,05 → nAA = a – 0,05 = 0,2 Gọi x ,y lần lượt là mol gly và ala và t là số nhóm CH2 trong RCOONa Ta có x + y = 0,2 x + 2y = 0,3 - 0,05t chọn t = 1 → x = 0,15 , y = 0,05 tỉ lệ Gly : Ala = 3:1
File đính kèm:
 de_thi_tot_nghiep_thpt_quoc_gia_nam_2018_mon_hoa_hoc_truong.doc
de_thi_tot_nghiep_thpt_quoc_gia_nam_2018_mon_hoa_hoc_truong.doc

