Đề thi thử THPT Quốc gia lần 2 môn Hóa học - Năm 2017-2018 - Trường THPT Lê Lợi (Có đáp án)
Bạn đang xem tài liệu "Đề thi thử THPT Quốc gia lần 2 môn Hóa học - Năm 2017-2018 - Trường THPT Lê Lợi (Có đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề thi thử THPT Quốc gia lần 2 môn Hóa học - Năm 2017-2018 - Trường THPT Lê Lợi (Có đáp án)
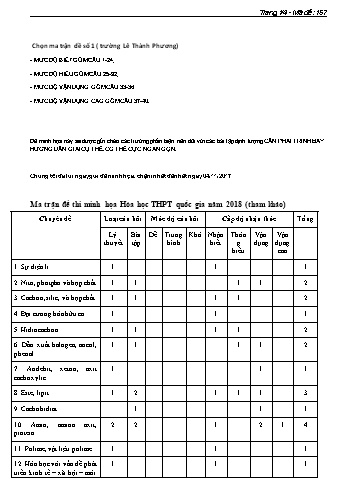
Trang 1/4 - Mã đề: 157 Chọn ma trận đề số 1 ( trường Lê Thành Phương) - MỨC ĐỘ BIẾT GỒM CÂU 1-24; - MỨC ĐỘ HIỂU GỒM CÂU 25-32; - MỨC ĐỘ VẬN DỤNG GỒM CÂU 33-36; - MỨC ĐỘ VẬN DỤNG CAO GỒM CÂU 37-40. Đề minh họa này sẽ được gửi chéo các trường phản biện nên đối với các bài tập định lượng CẦN PHẢI TRÌNH BÀY HƯỚNG DẪN GIẢI CỤ THỂ, CÓ THỂ CỰC NGẮN GỌN. Chúng tôi đã lùi ngày gửi đề minh họa, chậm nhất đến hết ngày 04/11/2017 Ma trận đề thi minh họa Hóa học THPT quốc gia năm 2018 (tham khảo) Chuyên đề Loại câu hỏi Mức độ câu hỏi Cấp độ nhận thức Tổng Lý Bài Dễ Trung Khó Nhận Thôn Vận Vận thuyết tập bình biết g dụng dụng hiểu cao 1. Sự điện li 1 1 1 2. Nitơ, photpho và hợp chất 1 1 1 1 2 3. Cacbon, silic, và hợp chất 1 1 1 1 2 4. Đại cương hóa hữu cơ 1 1 1 5. Hiđrocacbon 1 1 1 1 2 6. Dẫn xuất halogen, ancol, 1 1 1 1 2 phenol 7. Anđehit, xeton, axit 1 1 1 cacboxylic 8. Este, lipit 1 2 1 1 1 3 9. Cacbohidrat 1 1 1 10. Amin, amino axit, 2 2 1 2 1 4 protein 11. Polime, vật liệu polime 1 1 1 12. Hóa học với vấn đề phát 1 1 1 triển kinh tế – xã hội – môi Trang 3/4 - Mã đề: 157 Vậy công thức phân tử của Meth là. A. C11H17N.B. C 11H19N.C. C 10H15N.D. C 10H17N. Câu 7. Trong phòng thí nghiệm để bảo quản Na có thể ngâm Na trong : A. CH3COOH.B. C 2H5OH.C. H 2O. D. Dầu hoả. Câu 8. Chất nào sau đây là điện li yếu. A. NaCl. B. HCl. C. KOH. D. H2S. Câu 9. Cho thí nghiệm như hình vẽ: Hãy cho biết thí nghiệm này dùng để phân tích định tính nguyên tố nào trong hợp chất hữu cơ? A. Xác định C và N. B. Xác định H và Cl. C. Xác định C và O. D. Xác định C và H. Câu 10. Hiđrocacbon X không làm mất màu dung dịch brom ở nhiệt độ thường. Tên gọi của X là A. stiren. B. etilen.C. toluen. D. axetilen. Câu 11. Phản ứng nào sau đây không phải phản ứng oxi hoá - khử: A. FeS + 2HCl → FeCl2 + H2S .B. Fe + 2HCl → FeCl 2 + H2. t0 C. 2Fe + 3Cl2 2FeCl3. D. 2FeCl3 + Fe → 3FeCl2. Câu 12. Có năm dung dịch đựng riêng biệt trong năm ống nghiệm đó là: (NH4)2SO4, FeCl3 , Zn(NO3)2 , Na2CO3 và Al(NO3)3. Cho dung dịch Ba(OH)2 đến dư vào năm dung dịch trên. Sau khi phản ứng kết thúc, số ống nghiệm có kết tủa là. A. 5.B. 4.C. 3. D. 2. Câu 13. Một cốc nước có chứa các ion : Na + (0,02 mol), Mg2+ (0,02 mol), Ca2+ (0,04 mol), Cl- (0,02 - 2- mol), HCO (0,10 mol) và SO (0,01 mol). Đun sôi cốc nước trên cho đến khi phản ứng xảy ra hoàn 3 4 toàn thì nước còn lại trong cốc. A. là nước mềm. B. có tính cứng vĩnh cửu. C. có tính cứng tạm thời.D. có tính cứng toàn phần. Câu 14. Hỗn hợp X chứa Na 2O, NH4NO3, NaHCO3 và Ba(NO3)2 có số mol mỗi chất đều bằng nhau. Cho hỗn hợp X vào H2O (dư), đun nóng, dung dịch thu được chứa. A. NaNO3, NaOH, Ba(NO3)2.B. NaNO 3, NaOH. C. NaNO3.D. NaNO 3, NaHCO3 , NH4NO3, Ba(NO3)2 . Câu 15. Đốt cháy hoàn toàn este no, đơn chức, mạch hở (X) thấy thể tích O 2 cần đốt gấp 1,25 thể tích CO2 tạo ra. Số lượng công thức cấu tạo của X là: A. 4. B. 3. C. 6. D. 5. Câu 16. Đốt cháy hoàn toàn hỗn hợp X gồm hai ankan kế tiếp trong dãy đồng đẳng được 24,2 gam CO2 và 12,6 gam H2O. Công thức phân tử 2 ankan là: A. C2H6 và C3H8.B. CH 4 và C2H6. C. C4H10 và C5H12.D. C 3H8 và C4H10. FeSO4 H2SO4 NaOH(d) Br2 NaOH Câu 17. Cho sơ đồ chuyển hóa sau: K2Cr2O7 X Y Z Biết X, Y và Z là các hợp chất của crom. Hai chất Y và Z lần lượt là A. Cr(OH)3 và NaCrO2. B. NaCrO2 và Na2CrO4. C. Cr2(SO4)3 và NaCrO2. D. Cr(OH)3 và Na2CrO4. Câu 18. Cho hợp chất A có công thức phân tử là C4H9Cl. Số đồng phân cấu tạo mạch hở của hợp chất A là. A. 2. B. 6.C. 4. D. 3. Câu 19. Cho dãy các chất sau: glucozơ, etyl axetat, saccarozơ, isoamyl axetat, phenylamoni clorua, poli(vinyl axetat), glyxylvalin (Gly-Val), etilenglicol, triolein. Số chất tác dụng với dung dịch NaOH đun nóng là: Trang 1/4 - Mã đề: 191 Câu 32. Cho luồng khí CO dư qua ống sứ đựng 5,36 gam hỗn hợp FeO và Fe 2O3(nung nóng), thu được m gam chất rắn và hỗn hợp khí X. Cho X vào dung dịch Ca(OH)2 dư, thu được 9 gam kết tủa.Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là A. 3,92.B. 2,48. C. 3,75. D. 3,88. Câu 33. Công thức đơn giản nhất của anđehit no, mạch hở (X) có dạng C 2H3O. Vậy công thức phân tử của (X) là A. C4H6O2. B. C8H12O4. C. C2H3O. D. C3H9O3. Câu 34. Nung 7,84 gam Fe trong không khí, sau một thời gian, thu được 10,24 gam hỗn hợp rắn X. Cho X phản ứng hết với dung dịch HNO 3 (loãng, dư), thu được V ml khí NO (sản phẩm khử duy nhất của N+5, ở đktc). Giá trị của V là A. 2240. B. 896. C. 2688. D. 3136. Câu 35. Thủy phân hoàn toàn m gam một tetrapeptit X mạch hở thu được hỗn hợp Y gồm 2 amino axit (no, phân tử chứa một nhóm -COOH và một nhóm -NH 2) là đồng đẳng liên tiếp nhau. Đốt cháy hoàn toàn hỗn hợp Y cần vừa đủ 4,5 mol không khí (chứa 20% O 2 về thể tích còn lại là N 2) thu được CO2, H2O và 82,88 lít khí N2 (ở đktc). Số công thức cấu tạo thỏa mãn của X là: A. 4.B. 8.C. 6 D. 12. Câu 36. Hòa tan hoàn toàn m gam Al bằng dung dịch HNO3 loãng, thu được 5,376 lít (đktc) hỗn hợp khí X gồm N2, N2O và dung dịch chứa 8m gam muối. Tỉ khối của X so với H 2 bằng 18. Giá trị của m là A. 19,44.B. 21,6. C. 18,90. D. 17,8. Câu 37. Cho từ từ đến dư dung dịch HCl vào dung dịch X chứa a mol NaAlO 2, và b mol NaOH. Kết quả thí nghiệm được biểu diễn trên đồ thị sau. Vậy giá trị của a là A. 0,2.B. 0,3. C. 0,15.D. 0,35 Câu 38. Hòa tan hoàn toàn hỗn hợp X gồm CuSO 4 và KCl vào H2O, thu được dung dịch Y. Điện phân Y (có màng ngăn, điện cực trơ) đến khi H 2O bắt đầu điện phân ở cả hai điện cực thì dừng điện phân. Số mol khí thoát ra ở anot bằng 4 lần số mol khí thoát ra từ catot. Phần trăm khối lượng của CuSO4 trong X là: A. 50,63%. B. 34,93%. C. 44,61%. D. 61,70%. Câu 39. Hợp chất X có thành phần gồm C, H, O chứa vòng benzen. Cho 6,9 gam X vào 360 ml dung dịch NaOH 0,5 M (dư 20% so với lượng cần phản ứng) đến phản ứng hoàn toàn, thu được dung dịch Y. Cô cạn Y thu được m gam chất rắn khan. Mặt khác, đốt cháy hoàn toàn 6,9 gam X cần vừa đủ 7,84 lít O2 (đktc), thu được 15,4 gam CO2. Biết X có công thức phân tử trùng với công thức đơn giản nhất. Giá trị của m là. A. 12,3. B. 13,2 C. 11,1. D. 11,4. Câu 40. Nung hỗn hợp X gồm a mol Mg và 0,25 mol Cu(NO 3)2, sau một thời gian, thu được chất rắn Y và 0,45 mol hỗn hợp khí Z gồm NO 2 và O2. Cho Y phản ứng vừa đủ với dung dịch chứa 1,3 mol HCl, thu được dung dịch chỉ chứa m gam hỗn hợp muối clorua và 0,05 mol hỗn hợp khí T (gồm N2 và H2 có tỉ khối so với H2 là 11,4). Giá trị của m gần nhất với giá trị nào sau đây? A. 80. B. 82. C. 74. D. 72. Trang 3/4 - Mã đề: 191 FeSO4 + K2Cr2O7 + H2SO4 Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + H2O Cr2(SO4)3 + NaOH dư NaCrO2 (Y) + Na2SO4 + H2O NaCrO2 + Br2 + NaOH Na2CrO4 (Z) + NaBr + H2O Câu 18. Chọn C. C4H9Cl. Số đồng phân cấu tạo mạch hở của hợp chất A là. CH3-CH2-CH2-CH2Cl, CH3-CH2-CH2Cl-CH3 , CH3-CH(CH3)-CH2Cl và CH3-CCl(CH3)-CH3 Câu 19. Cho B : Gồm các chất sau: etyl axetat, isoamyl axetat, phenylamoni clorua, poli(vinyl axetat), glyxylvalin (Gly-Val), triolein. Câu 20. Chọ A. Khi cho axit HCl vào dung dịch chứa Na2CO3 xảy ra 2 gia đoạn sau + 2– – + – H + CO3 HCO3 (1) H + HCO3 CO2 + H2O (2) b b b (a – b) b Có khí nên có phản ứng (2), nước vôi trong vào dung dịch X thấy có xuất hiện kết tủa nên – HCO3 dư sau (2) Vậy nCO2 = a – b V = 22,4(a - b). Câu 21. Chọn D: dd AgNO3. Câu 22. Chọn B. Ni, t0 Phản ứng CH2OH (CHOH)4 CHO H2 CH2OH (CHOH)4 CH2OH 4,55 Trong m gam glucozơ có: n n 0,25 (mol) C6H12O6 C6H14O6 182 Trong 2m gam glucozơ có chứa: n 2.0,25 0,05 (mol) C6H12O6 Mà C6H12O6 2Ag mAg 108.2.0,05 10,8 (gam) Câu 23. Chọn C: amoni acrylat và axit 2-aminopropionic. Câu 24. Chọn B: 2+ 3+ + 2- - Dung dịch X chứa Fe , Fe , H dư, SO4 . 2KMnO4 10FeSO4 8H2SO4 5Fe2 (SO4 )3 K2SO4 2MnSO4 4H2O 2 3 2Fe Cl2 2Fe 2Cl H OH H2O ; 2 2 Fe 2OH Fe(OH)2 ; Fe 3OH Fe(OH)3 2 3 2 2H CO CO2 H2O; Fe CO 2H2O Fe(OH)3 CO2 H 3 3 2 2 3 2 2 Fe CO FeCO3 Cu 2Fe Cu 2Fe 3 2 3 3Fe 4H NO3 3Fe NO 2H2O Câu 25. Chọn A. Ta có sơ đồ sau: Trang 1/4 - Mã đề: 225 BTKL ta có: mMuối = 30,65 + 40.0,4 - 32.0,4 = 33,85 Câu 30. Chọn D: Gọi số mol của các muối NaH2PO4, Na2HPO4 và Na3PO4 lần lượt là x, y, và z TĐTC: 120x + 142y + 164z = 5,73 (1) H PO 2OH PO3 2H O HPO2 OH PO3 H O PỨTH: 2 4 4 2 và 4 4 2 x 2x x y y y nOH 2x y 0,075 (mol) (2) Lấy (2).22 ta được phương trình : 44x + 22y = 1,65 (3) Cộng (1) và (3) vế theo vế ta có: 164x + 164y + 164z = 7,38 x y z n 3 PO4 3- Vậy dung dịch Z chứa 0,045 mol PO4 , cho tác dụng với lượng dư dung dịch AgNO3 + 3- 3Ag + PO4 → Ag3PO4 0,045 0,045 => m(kết tủa) = 419.0,045 = 18,855 Câu 31. Khi đốt cháy hoàn toàn m gam hỗn hợp hai ancol no, đơn chức, mạch hở thu được V lít khí CO2 (ở đktc) và a gam H2O. Biểu thức liên hệ giữa m, a và V là: V V V V A. m 2a .B. m a . C. m a . D. m 2a . 22,4 5,6 5,6 11,2 Câu 32. Chọn A CO CO2 CaCO3 9 n n n 0,09 (mol) CO CO2 CaCO3 100 BTKL: m 5,36 26.0,09 44.0,09 3,92 (gam) Câu 33. Chọn A (1) Đưa về (C2H3O)n khai triển về dạng CnH2n(CHO)n (2) mà Công thức của anđehit no, mạch hở có dạng CmH2m+2-a(CHO)a Cách đg cho: Thế a = n và m = n vào pt 2m + 2 – a = 2n suy ra n = 2 CTPT C4H6O2 . Câu 34. Chọn B - Ta có: 10,24 7,84 3nFe 2nO nO 0,15 mol VNO 22,4. 0,896 (lít) 896 (ml) 16 3 Câu 35. Cho C Theo đề ta có: 4,5 n 0,9 (mol) và n 0,9.4 3,6 (mol) O2 KK 5 N2 KK 82,88 n 3,7 (mol) n 3,7 3,6 0,1 (mol) N2 sau 22,4 N2 (do Ysinh ra) Đặt CTPT trung bình của 2 amino axit là: C H O N (n 2) n 2n 1 2
File đính kèm:
 de_thi_thu_thpt_quoc_gia_lan_2_mon_hoa_hoc_nam_2017_2018_tru.doc
de_thi_thu_thpt_quoc_gia_lan_2_mon_hoa_hoc_nam_2017_2018_tru.doc

