Đề minh họa THPT Quốc gia 2018 môn Hóa học - Trường THPT Trần Suyền (Có đáp án)
Bạn đang xem tài liệu "Đề minh họa THPT Quốc gia 2018 môn Hóa học - Trường THPT Trần Suyền (Có đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề minh họa THPT Quốc gia 2018 môn Hóa học - Trường THPT Trần Suyền (Có đáp án)
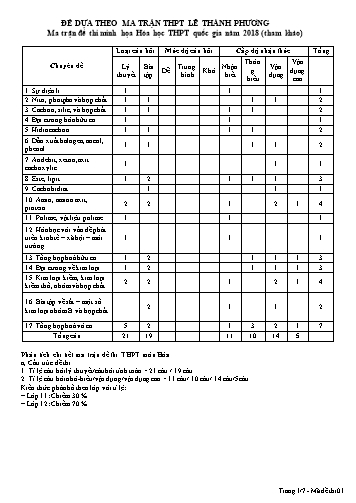
ĐỀ DỰA THEO MA TRẬN THPT LÊ THÀNH PHƯƠNG Ma trận đề thi minh họa Hóa học THPT quốc gia năm 2018 (tham khảo) Loại câu hỏi Mức độ câu hỏi Cấp độ nhận thức Tổng Thôn Vận Chuyên đề Lý Bài Trung Nhận Vận Dễ Khó g dụng thuyết tập bình biết dụng hiểu cao 1. Sự điện li 1 1 1 2. Nitơ, photpho và hợp chất 1 1 1 1 2 3. Cacbon, silic, và hợp chất 1 1 1 1 2 4. Đại cương hóa hữu cơ 1 1 1 5. Hiđrocacbon 1 1 1 1 2 6. Dẫn xuất halogen, ancol, 1 1 1 1 2 phenol 7. Anđehit, xeton, axit 1 1 1 cacboxylic 8. Este, lipit 1 2 1 1 1 3 9. Cacbohidrat 1 1 1 10. Amin, amino axit, 2 2 1 2 1 4 protein 11. Polime, vật liệu polime 1 1 1 12. Hóa học với vấn đề phát triển kinh tế – xã hội – môi 1 1 1 trường 13. Tổng hợp hoá hữu cơ 1 2 1 1 1 3 14. Đại cương về kim loại 1 2 1 1 1 3 15. Kim loại kiềm, kim loại 2 2 1 2 1 4 kiềm thổ, nhôm và hợp chất 16. Bài tập về sắt – một số 2 1 1 2 kim loại nhóm B và hợp chất 17. Tổng hợp hoá vô cơ 5 2 1 3 2 1 7 Tổng câu 21 19 11 10 14 5 Phân tích chi tiết ma trận đề thi THPT môn Hóa a, Cấu trúc đề thi 1. Tỉ lệ câu hỏi lý thuyết/câu hỏi tính toán = 21 câu / 19 câu. 2. Tỉ lệ câu hỏi nhớ-hiểu/vận dụng/vận dụng cao = 11 câu/ 10 câu/ 14 câu/5câu. Kiến thức phân bố theo lớp với tỉ lệ: – Lớp 11: Chiếm 30 % – Lớp 12: Chiếm 70 % Trang 1/7 - Mã đề thi 01 Câu 16: Cho các phát biểu sau: (a) Ag là kim loại dẫn điện tốt nhất còn Cr là kim loại cứng nhất. (b) Phản ứng hóa học giữa Hg và S xảy ra ngay ở điều kiện thường. (c) Ăn mòn hóa học là quá trình oxi hóa khử, trong đó các electron của kim loại được chuyển từ cực âm đến cực dương. (d) Kim loại đồng chỉ có thể điều chế bằng phương pháp điện phân dung dịch muối của nó. Số phát biểu đúng là: A. 1 B. 4 C. 3 D. 2 Câu 17: Thể tích dung dịch NaOH 2M tối thiểu để hấp thụ hết 5,6 lít SO2 ở đktc là: A. 250 ml B. 500 ml C. 125 ml D. 175 ml GỢI Ý - Tạo muối axit(NaHCO3): mol NaOH= molSO2 = 0,25 - VddNaOH= 125 ml Câu 18: Hòa tan m(g) Fe trong dung dịch HCl dư, sau khi phản ứng kết thúc thu được 4,48 lít khí H 2 (ở đktc). Giá trị của m là (Cho Fe = 56, H = 1, Cl = 35,5) A. 2,8 B. 1,4 C. 5,6 D. 11,2 GỢI Ý nFe = 0.2 => mFe =0.2*56= 11,2g Câu 19: Xà phòng hóa 22,2 g hỗn hợp 2 este là HCOOC 2H5 và CH3COOCH3 đã dùng hết 200ml dung dịch NaOH. Nồng độ mol của dd NaOH là : A. 0,5M B. 1M C. 1,5M D. 2M GỢI Ý KLPT của 2 este bằng nhau nhh = 22,2/74=0,3 mol. 2 Este đơn chức nên nNaOH =neste =0,3 CNaOH=1,5 M. Câu 20: Cho hình vẽ bên minh họa việc điều chế khí Y trong phòng thí nghiệm. Khí Y là khí N2 thì dung dịch X là A. NH4NO3 B. NH4Cl và NaNO2 C. H2SO4 và Fe(NO3)2 D. NH3 Câu 21: Thực hiện các thí nghiệm sau: (1) Cho dung dịch Na2CO3 vào dung dịchAl2(SO4)3. (2) Cho dung dịch hỗn hợp HCl và NaNO3 vào dung dịchFeCl2. (3) Cho dung dịch HCl vào dung dịchFe(NO3)2. (4) Cho dung dịch NaHCO3 vào dungBaCl2. (5) Cho dung dịch NaHCO3 vào dung dịch NaHSO4. Số trường hợp xảy ra phản ứnglà: A. 2 B. 3 C. 4 D. 5 Câu 22: Cho 4,8 gam kim loại R hoá trị II tan hoàn toàn trong dung dịch HNO3 loãng thu được 1,12 lít khí NO là sản phẩm khử duy nhất (đktc). Kim loại R là: A. Zn B. Mg C. Fe D. Cu GỢI Ý - Đlbt e: 2nR = 3*0,05 nR= 0,075 - MR = 64(Cu) Câu 23: Cho ba hiđrocacbon X, Y, Z. Nếu đốt cháy 0,25 mol mỗi chất thì thể tích khí CO2 thu được không quá 17 lít (đo ở đktc). Thực hiện các thí nghiệm thấy có hiện tượng như bảng sau: Chất X Y Z Phản ứng với Dung dịch AgNO3/NH3 Kết tủa vàng Không có kết tủa Không có kết tủa Dung dịch brom Mất màu Mất màu Không mất màu Công thức cấu tạo của X, Y, Z lần lượt có thể tương ứng là: A. CH3– C C – CH3; CH2= CH – CH = CH2; CH3– CH2– CH2-CH3 B. CH2= C = CH2; CH2= CH – CH3; CH3– CH2–CH3 C. CHCH; CH2=CH – CH=CH2; CH3 –CH3 D. CHC – CH3; CH2 = CH – CH3; CH3 –CH3 Trang 3/7 - Mã đề thi 01 mrắn =0,1 .40 + 0,1.85 =12,5 g. Câu 30: Hòa tan hoàn toàn 20g hỗn hợp A gồm Mg và Fe2O3bằng dung dịch HNO3 đặc dư thu được dung dịch B và V lit khí NO2 (dktc) là sản phẩm khử duy nhất. Thêm NaOH dư vào dung dịch B. Kết thúc thí nghiệm, lọc lấy kết tủa đem nung trong không khí đến khối lượng không đổi thu được 28g chất rắn. Giá trị của V là: A. 44,8 lit B. 33,6 lit C. 22,4 lit D. 11,2 lit GỢI Ý 20g (Mg,Fe2O3) 28g (MgO,Fe2O3) => n[O] = (28-20)/16 = 0,5mol = nMg BT eletron 2*0,5 =n NO2 => VNO2 = 22,4lit Câu 31: Đốt cháy hoàn toàn 1 amin X đơn chức thu được 16,8 lít CO2 ; 2,8 lít N2 và 20,25 g H2O. Các thể tích khí đo ở điều kiện tiêu chuẩn .CTPT của X là: A. CH5N B. C3H9N C. C2H7N D. C4H11N GỢI Ý Số mol CO2 =0,75 nC =0,75 Số mol H2O =1,125 mol nH =2,25 Số mol N2 =0,125 nN =0,25 Đặt CT dạng CxHyNt x:y:t=0,75:2,25 :0,25 =3:9:1 Câu 32: Một loại phân supephotphat kép có chứa 69,62% muối canxi đihiđrophotphat, còn lại gồm các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này: A. 42,25% B. 39,76% C. 48,52% D. 45,75% GỢI Ý Ca(H2PO4)2 P2O5 234 g/mol 142 g/mol 100g phân 69,62 g m= 69,62*142/234 = 42,248g Câu 33: Đốt cháy hoàn toàn 1 hidrocacbon X, hấp thụ toàn bộ sản phẩm cháy bằng nuớc vôi trong dư. Sau phản ứng hoàn toàn thu được 27,93g kết tủa và thấy khối luợng dung dịch giảm 5,586g. Công thức phân tử X là: A. C3H6 B. C4H8 C. CH4 D. C4H10 GỢI Ý: Vận dụng xác định thành phần của chất hữu cơ ,số liên kết pi có trong chất hũư cơ CO2 + Ca(OH)2 → CaCO3 + H2O 0,2793 0,2793 nH2O = (mkết tủa - mgiảm - m CO2 )/18 = 0,5586 mol CnH2n+2-k + (3n+1-k)/2 O2 → n CO2 + ( n+ 1-k) H2O a mol → na → ( n+ 1-k) a n H2O > n CO2 → k < 1→ k=0 n= n CO2 / (n H2O - n CO2 ) = 1 CH4 đáp án C Câu 34: Crackinh 0,1 mol pentan được hỗn hợp X. Đốt cháy hết X rồi hấp thụ sản phẩm cháy bởi nước vôi trong dư. Hỏi khối lượng dung dịch cuối cùng thu được tăng hay giảm bao nhiêu gam ? A. giảm 17,2 g B. Tăng 32,8 g C. tăng 10,8 g D. Tăng 22g GỢI Ý Áp dụng BTKL : mhhX = m C5H12 Đốt cháy hhX cũng giống đốt cháy C5H12 C5H12 + O2 → 5CO2 + 6 H2O 0,1 mol 0,5 mol 0,6 mol CO2 + Ca(OH)2 → CaCO3 + H2O 0,5 0,5 mol Ta có : mCO2 + m H2O = 32,8 g mCaCO3 = 50 g ta thấy mCaCO3 = 50 g > mCO2 + m H2O = 32,8 g khối lượng dung dịch giảm b 50-32,8 = 17,2 g Câu 35: Cho từ từ 150 ml dung dịch HCl 1M vào 500 ml dung dịch A gồm Na 2CO3 và KHCO3 thì thu được 1,008 lít khí (đkc) và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch Ba(OH) 2 dư thu được 29,55 g kết tủa. Nồng độ của Na2CO3 và KHCO3 trong dung dịch lần lượt là: A. 0,2 M và 0,4M B. 0,18 M và 0,26 M C. C.0,21 M và 0,37 M D. 0,21 M và 0,18 M GỢI Ý Na2CO3 x mol; KHCO3 y mol; mol CO2= 1,008/22,4=0,045; mol BaCO3=0,15 2- + - -CO 3 +H → HCO3 (1) Trang 5/7 - Mã đề thi 01 Câu 40 : Hỗn hợp X gồm 1 axit cacboxylic đơn chức Y, ancol đơn chức Z, 1 este tạo ra từ Y và Z. Khi đốt cháy hoàn toàn 6,2 gam X thu được 0,31 mol CO2, 0,28 mol H2O. Còn khi cho 6,2 gam X pứ vừa đủ với 50ml dd NaOH 1M đun nóng thu được 0,04 mol Z. Thành phần % số mol Y trong X là A. 42,86%. B. 36,72%. C. 32,15%. D. 57,14%. GỢI Ý Đặt công thức axit: RCOOH( a mol), ancol: R’OH (b mol), este: RCOOR’ (c mol) ĐL bảo toàn khối lượng , mO2 =12,48g nO2 =0,39. Bảo toàn nguyên tố Oxi: 2a + b+ 2c =0,12 (1) RCOOH + NaOH RCOONa + H2O. a a RCOOR’ + NaOH RCOONa + R’OH. c c c Dựa vào giả thuyết , ta có: a +c =0,05 (2) , b+ c= 0,04 (3). Từ pt (1),2),(3) a= 0,03 , b=0,02 , c=0,02 %naxit = 42,86%. ----------- HẾT ---------- Trang 7/7 - Mã đề thi 01
File đính kèm:
 de_minh_hoa_thpt_quoc_gia_2018_mon_hoa_hoc_truong_thpt_tran.doc
de_minh_hoa_thpt_quoc_gia_2018_mon_hoa_hoc_truong_thpt_tran.doc

